夏季热应激是导致泌乳奶牛生育能力低下的主要因素之一。热应激导致母体体温过高,生殖道细胞出现各种功能障碍,生育能力低下。研究表明,GV期阶段卵母细胞发育能力受损是夏季生育能力低下的原因之一。研究人员在夏季时从中等大小的窦卵泡(直径2-8毫米)收集的卵母细胞,在体外受精或化学激活孤雌生殖后的发育能力低于凉爽季节的卵母细胞。虽然早期窦卵泡阶段是卵母细胞获得发育能力的关键阶段,但目前还没有关于热应激对早期窦卵泡生长影响的报道。
来自窦卵泡(2-8 mm)的GV期热应激卵母细胞的低发育能力与膜脂肪酸谱的变化增加及参与卵子发生、卵泡发生和胚胎发育的基因转录水平的改变有关。暴露于体外高温或夏季收集的GV期卵母细胞也表现出细胞核和细胞质的破坏,包括皮质颗粒易位至卵膜,以及成熟卵母细胞中线粒体分布和极化受损。然而,GV期卵母细胞在生长过程中发育能力受到破坏的机制仍不清楚。
发育卵泡中类固醇生成的变化可能与夏季卵母细胞发育能力降低有关。类固醇激素是卵泡生长过程中卵母细胞获得发育能力所需的重要因素。在体外,雌二醇(E2)对于在早期窦卵泡(直径0.4-0.7毫米)衍生的牛卵母细胞复合物的体外培养过程中获得成熟和发育能力至关重要。体内研究表明,在高温季节时发情周期的第7天,优势卵泡的卵泡液中E2浓度低于低温季节。各种大小的窦卵泡的类固醇生成能力也会受到热应激的破坏。在急性热应激后3周,从中等大小的卵泡(直径6-9毫米)获得的培养颗粒和膜细胞中E2和雄烯二酮(A4)的产生水平降低,表明早期窦卵泡对热应激敏感。尚未直接研究在热应激影响下生长卵泡中的类固醇生成与卵母细胞发育能力之间的关系。
高温诱导的氧化应激被认为是热应激损害卵母细胞发育能力的另一种潜在机制。体外成熟系统的研究表明,热暴露会增加牛卵母细胞中的细胞内ROS水平,并降低囊胚率。谷胱甘肽是哺乳动物细胞中含量最丰富的非蛋白质硫醇,还原型谷胱甘肽(GSH)可维持细胞氧化还原状态,并保护细胞免受ROS侵害。颗粒细胞具有在通过跨带突起(TZP)的胞间连接向卵母细胞提供GSH的关键作用。卵母细胞中细胞内GSH水平的降低伴随着IVM期间热暴露引起的细胞内ROS水平的增加。在IVM培养基中添加半胱氨酸可刺激GSH合成,降低卵母细胞中的ROS水平并减轻热暴露对卵母细胞发育能力的负面影响。
一项研究旨在通过给奶牛喂食具有抗氧化能力的不饱和脂肪酸来提高夏季奶牛的卵母细胞质量。然而,喂养过程并没有提高收集到的卵母细胞的发育能力。如果我们可以通过使用IVG培养系统开发一个模拟热应激下卵泡生长的实验模型,评估补充某些物质(即抗氧化剂)对生长期受热应激的卵母细胞发育能力的影响可能更容易。实验模型中选择的有效物质可用于在夏季管理奶牛,为IVM(体外成熟)收集更优质的卵母细胞,并在随后的秋季提高生育能力。
在体内,季节性热应激可能不仅会通过高温损害卵母细胞在生长期的发育能力,也可能通过热应激环境下的其他生理变化(即促性腺激素分泌受损,由于采食量减少导致的代谢系统改变等)。而在本研究中,我们旨在使用牛卵母细胞的IVG培养系统,研究生理范围内的高温对GV期卵母细胞在生长期的影响。IVG培养使来自早期窦卵泡(直径0.5-1毫米)的没有成熟能力的卵母细胞能够生长并获得成熟和发育能力以发育到囊胚阶段。首先,我们检查了IVG培养过程中热暴露对囊胚阶段的生长、成熟和随后的发育能力的影响。其次,为了研究热暴露降低GV期卵母细胞发育能力的机制,我们评估了颗粒细胞产生的E2和孕酮 (P4),卵母细胞的细胞内ROS和GSH水平,以及卵母细胞和卵丘细胞之间的TZP数量。第三,我们研究了在IVG培养基中添加半胱氨酸对GSH水平的拯救作用以及在IVG期间暴露于高温的卵母细胞的发育能力。
实验1:
IVG培养过程中热暴露对OCGC形态、卵母细胞生长以及卵母细胞成熟和发育能力的影响
为了检查热暴露对卵母细胞生长、成熟和发育能力的影响,我们在两种不同的温度设置(对照组和热休克组;图1a)下对源自早期窦卵泡的牛OCGC进行了IVG。在对照组中,OCGC在38.5℃下培养12天,模拟非热应激奶牛的体温。在热休克组中,OCGCs采用38.5℃ 5小时、39.5℃ 5小时、40.5℃ 5小时和39.5℃ 9小时12天的温度循环培养,模拟热应激下奶牛的体温。在IVG培养后,对卵母细胞进行IVM、IVF和胚胎体外培养(IVC),评估卵母细胞的直径、核成熟能力和发育能力(图1b)。根据受精卵母细胞的数量计算囊胚率。在IVG培养期间,我们观察了两组OCGC的形态学表现(图2),但对照组和热休克组之间OCGC的活力或腔形成率没有显着差异(图3a、b)。组别和培养期的卵母细胞的平均直径有显着差异(P < 0.001)(图3c)。此外,组别和培养期对卵母细胞平均直径有显著的交互作用(P < 0.001)。对照组卵母细胞的平均直径从IVG前的101.4 µm增加到IVG和IVM后的113.5 µm (P < 0.05)。热休克组直径的增加也很显着(从101.4到109.4 µm,P < 0.05),而热休克组IVG和IVM后卵母细胞的平均直径明显小于对照组(P < 0.05)。对照组(分别为62.1%和55.3%)和热休克组(分别为51.9%和45.8%)之间的核成熟和分裂率相似(图3c,表1)。然而,热休克组没有卵母细胞发育成囊胚(0.0%),而对照组有27.7%的卵母细胞发育成囊胚(P < 0.05)(表1)。
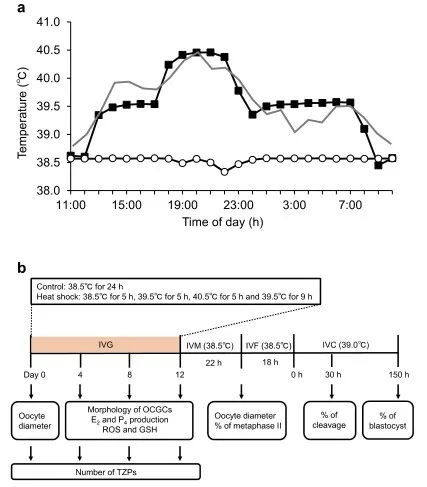
图1.对照组和热休克组体外生长(IVG)培养过程中的温度条件(a)和实验设计示意图(b)。(a) 热应激下泌乳奶牛直肠温度的每日变化(实线),以及热休克组(实心正方形)和对照(空心圆)的培养温度,由放置在孵化器中的数据记录器监测(连续12天每小时测量的平均温度)。热休克组中的卵母细胞-卵丘-颗粒复合物(OCGC)在与热应激奶牛所经历的温度相似的温度范围内培养。对照组的OCGCs在38.5℃的恒温下培养24小时,模拟没有热应激的奶牛的体温。(b)来自早期窦卵泡(直径0.5-1毫米)的OCGC在IVG培养中培养0、4、8或12天。在IVG培养的第0天评估卵母细胞直径。在IVG培养期间(第4、8和12天)每4天评估OCGC的形态(OCGC的活力和颗粒细胞层中的腔形成)。经过12天的IVG,一些存活的OCGC进行了IVM。在IVM之后,评估了一些卵母细胞的直径和核状态。IVM后的一些卵母细胞进行IVF和IVC以评估发育能力。在IVM(生长和核状态评估)或IVC(发育能力评估)之前培养的OCGC来自不同的培养阶段。在IVG培养期间,每4天评估IVG培养基中E2和P4的浓度,及卵母细胞中的ROS和GSH水平(第4、8和12天)。在第0天和IVG培养期间每4天(第4、8和12天)评估TZP的数量。
图2.IVG培养12天前后OCGC的形态。(a)IVG培养前分离的OCGC。(b) IVG培养12天后,在颗粒细胞层中没有腔形成的OCGC存活。(c)在颗粒细胞层中存活的OCGC形成腔(白色箭头)。(d) IVG培养12天后退化的OCGC。比例尺=100 µm。
图3.IVG过程中热休克对OCGC的活力(a)、腔形成的影响(b),以及IVM后卵母细胞的生长和核状态(c)。括号中的数字表示OCGC的数量。(a)OCGCs的存活率是根据689个OCGCs计算得出的,这些OCGCs被培养到IVG培养结束(12天)(对照组345个,热休克组344个)。(b)根据第12天存活的406个OCGC(对照组208个,热休克组198个)计算颗粒细胞层中腔形成的百分比。abc不同字母表示同组培养时间差异显着(P < 0.05)。(c)图中方框上的线描绘了第25、50和75个百分位数,而虚线描绘了第10个和第90个百分位数。图中方框下方的值表示卵母细胞的平均直径(µm)。括号中的数字表示为IVM的卵母细胞数量。a-c不同字母表示差异显着(P < 0.01)。
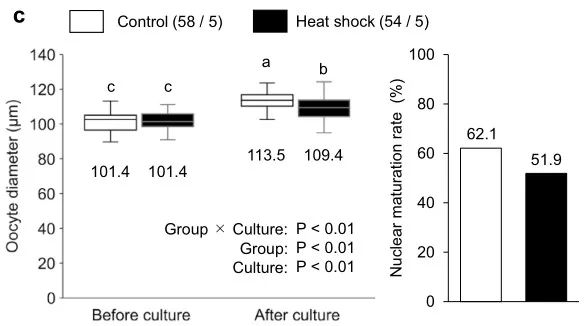
表1. OCGC体外生长培养过程中热暴露对其卵母细胞发育能力的影响。囊胚中的细胞数表示为平均值±SEM。*囊胚率是根据受精卵母细胞的数量计算的。不同上标表示组间差异显着(P < 0.05)。
实验2:
IVG培养过程中热暴露对颗粒细胞类固醇生成、卵母细胞中ROS和GSH水平以及卵母细胞中TZP数量的影响
为了阐明热休克组发育能力受损的机制,我们评估了颗粒细胞产生的E2和P4,卵母细胞中的细胞内ROS和GSH水平,及卵母细胞和卵丘细胞间的TZP数量,这与卵母细胞的发育能力有关(图1b)。对照组和热休克组的E2和P4生产水平相似(图4)。在两组中,从第0-4天到第4-8天的E2量增加一直保持到IVG培养结束(第8-12天)。另一方面,P4含量在培养期间不断增加。两组之间的E2/P4比率没有差异。两组卵母细胞中的细胞内ROS水平没有差异(图5);然而,在第8天和第12天,热休克组卵母细胞中的GSH水平低于对照组(P < 0.05)(图6)。卵母细胞和周围卵丘细胞之间的TZP数量在两组之间没有差异(图 7)。在两组中,TZP的数量在IVG培养的第8天都减少了。
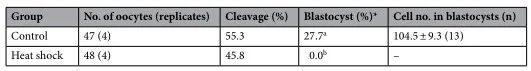
图4. IVG培养过程中热休克对OCGC产生E2和P4以及培养基中E2/P4比率的影响。不同字母表示同一组内培养期之间存在显着差异(P < 0.05)。误差线表示 SEM。
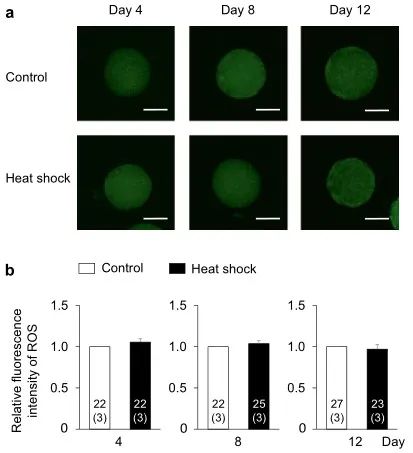
图5. IVG培养过程中热休克对卵母细胞细胞内ROS水平的影响。(a)用2',7'-二氯二氢荧光素二乙酸酯(DCHFDA)检测的IVG卵母细胞的代表性荧光显微照片。在对照组(上图)和热休克组(下图)的IVG培养期间(第4、8和12 天),每4天评估一次卵母细胞中的细胞内ROS水平。比例尺=50 µm。(b)在IVG培养期间 (第4、8和12天) 每4天对照和热休克组的ROS水平的相对荧光强度。使用总共141个卵母细胞(每个三个重复)测量ROS的荧光强度。条形图中的数字表示卵母细胞的数量,而重复的数量显示在括号中。在同一培养日将热休克组的荧光强度标准化为对照组的荧光强度。
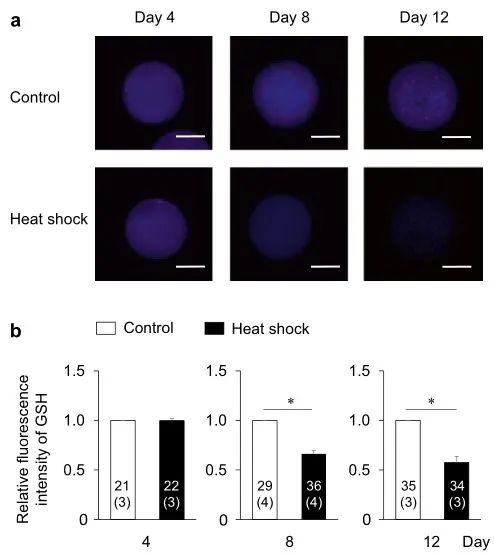
图6. IVG培养过程中热休克对卵母细胞内GSH水平的影响。(a)用CellTracker Blue检测到的IVG卵母细胞的代表性荧光显微照片。在对照组(上图)和热休克组(下图)的IVG培养期间(第4、8和12天),每4天评估一次卵母细胞中的细胞内GSH水平。比例尺=50 µm。(b)在IVG培养期间(第4、8和12天),对照组和热休克组每4天的GSH水平的相对荧光强度。使用总共177个卵母细胞(每个3-4个重复)测量GSH的荧光强度。条形图中的数字表示卵母细胞的数量,而重复的数量显示在括号中。在同一培养日将热休克组的荧光强度标准化为对照组的荧光强度。*星号表示同一天对照组和热休克组之间存在显着差异(P < 0.05)。
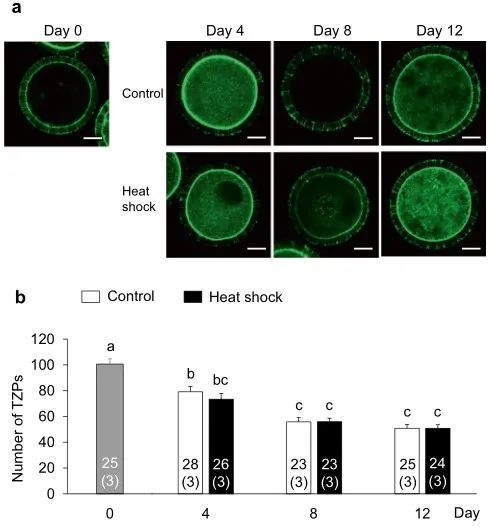
图7. IVG培养过程中热休克对卵母细胞和卵丘细胞之间的TZP数量的影响。(a)用荧光素异硫氰酸酯标记的鬼笔环肽检测卵母细胞和周围卵丘细胞之间的TZP荧光染色。在对照组(上图)和热休克组(下图)的第0天(左上图)和IVG培养期间(第4、8和12天)每4天评估TZP的数量。比例尺=25µm。(b)在第0天,及在IVG培养期间每4天(第4、8和12天)来自对照组和热休克组的IVG卵母细胞中TZP的数量。使用总共174个卵母细胞(每个三个重复)评估TZP的数量。条形图中的数字表示卵母细胞的数量,而重复的数量显示在括号中。不同字母表示差异显着(P < 0.05)。
实验3:
补充半胱氨酸对IVG培养过程中高温暴露的卵母细胞发育能力和GSH水平的影响
为了阐明促进OCGC中的GSH合成是否能恢复IVF期间暴露于高温的卵母细胞的发育能力,我们研究了在培养基中补充半胱氨酸对IVF期间暴露于高温的卵母细胞发育能力的影响。在实验中,我们检查了未处理的半胱氨酸组(补充有0.0 mM半胱氨酸的IVG培养基)和半胱氨酸处理组(补充有1.2 mM半胱氨酸的IVG培养基)。在之前的一项研究中,向培养基中添加1.2 mM半胱氨酸可提高GSH水平并提高IVM期间暴露于高温的卵母细胞的发育能力,因此本研究采用该半胱氨酸浓度。半胱氨酸处理组(67.4%)和半胱氨酸未处理组(57.1%)之间的卵裂率相似(表2)。然而,半胱氨酸处理组的囊胚率(27.9%)显着高于半胱氨酸未处理组(6.1%)(P < 0.05)。此外,半胱氨酸处理组的囊胚细胞数(122.1±10.8)略高于半胱氨酸未处理组(74.3±6.8)(P=0.06)。IVG培养12天后卵母细胞中的细胞内GSH水平在半胱氨酸处理组中高于半胱氨酸未处理组(P<0.05)(图8)。
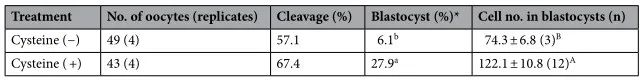
表2.半胱氨酸补充剂对IVG培养过程中暴露于高温的卵母细胞发育能力的影响。囊胚中的细胞数表示为平均值±SEM。*囊胚率是根据受精卵母细胞的数量计算的。不同上标表示组间差异显着(P < 0.05)。A ,B不同的上标表示组间的细微差异(P = 0.06)。
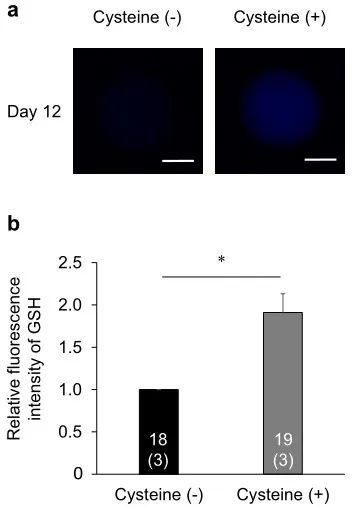
图8.半胱氨酸补充剂对IVG培养过程中暴露于高温的卵母细胞GSH水平的影响。(a)用CellTracker Blue检测到的IVG卵母细胞的代表性荧光显微照片。在半胱氨酸未处理组(左图)和半胱氨酸处理组(右图)的IVG培养第12天评估细胞内GSH水平。比例尺=50µm。(b) IVG培养第12天后半胱氨酸未处理组和处理组GSH水平的相对荧光强度。使用总共37个卵母细胞(每个重复三个)测量GSH的荧光强度。条形图中的数字表示卵母细胞的数量,而重复的数量显示在括号中。半胱氨酸处理组中卵母细胞的荧光强度标准化为半胱氨酸未处理组中的那些。*星号表示半胱氨酸未处理组和处理组之间存在显着差异(P < 0.05)。
讨论
据我们所知,我们首次证明,IVG培养过程中的热暴露会损害源自早期窦卵泡(0.5-1 mm)的卵母细胞的生长和发育能力。卵母细胞中的细胞内GSH耗竭可能是早期窦状卵泡的卵母细胞生长过程中热暴露导致卵母细胞发育能力受损的原因之一。
尽管对照组和热休克组的卵裂率相似,但热休克组的囊胚率明显低于对照组。结果与之前的研究相似,研究比较了夏季和冬季来自3至8毫米卵泡的卵母细胞的发育能力。研究还表明,各组之间的卵裂率相似或夏季略低于冬季,而夏季囊胚率明显低于冬季。然而,他们比较了两个不同实验术语和使用不同卵母细胞来源的结果。我们的实验模型可用于研究夏季热应激损害在对照组和热休克组之间同时使用相同卵母细胞来源的卵母细胞发育能力的机制。
热休克组IVG和IVM后卵母细胞的平均直径明显小于对照组。卵母细胞生长受损可能是与热暴露引起的卵母细胞发育能力降低相关的特征之一。众所周知,减数分裂成熟和随后的胚胎发育的全部能力是在卵母细胞直径约为110µm时获得的。因此,卵母细胞直径≥110µm可能是确定卵母细胞是否会获得后续发育能力的重要指标。在本研究中,对照组(75.9%)的卵母细胞直径≥110µm的百分比高于热休克组(46.3%)(P<0.01),与之前的研究一致。
对照组和热休克组之间的E2和P4生产水平没有差异。腔形成率(可以作为OCGC中健康类固醇生成的指标)在两组之间没有差异。先前的研究表明,在牛IVG中,形成腔的OCGC比没有腔的OCGC产生更多的E2和更少的P4。另一方面,夏季热应激降低了泌乳后期奶牛外周E2浓度和优势卵泡液中E2浓度。泌乳奶牛优势卵泡的卵泡液中P4浓度不受季节性热应激的影响。与体内情况相比,我们无法发现E2产生有任何差异的一个可能原因可能是本研究中IVG培养系统中没有膜细胞。热应激可能通过抑制全身内分泌系统或体内膜细胞的功能来抑制E2的产生。先前显示热应激可减少泌乳奶牛的促黄体激素(LH)数量。此外,膜细胞对热应激高度敏感;季节性热应激大大降低了膜细胞A4的产生,并且这种减少似乎在夏季热应激结束后会持续很长时间。这些变化可能导致体内颗粒细胞分泌E2的下降。研究结果清楚地表明,来自早期窦卵泡的颗粒细胞对高温的抵抗力相对较高,以维持类固醇生成,这是卵泡生长过程中颗粒细胞的主要生理功能。
尽管对照组和热休克组卵母细胞中的细胞内ROS水平没有差异,但热休克组卵母细胞中的GSH水平低于对照组。GSH是最重要的ROS清除剂之一。热休克组的GSH消耗可能高于对照组,以减轻卵母细胞细胞质中增加的氧化应激。在本研究中,在第8天和第12天观察到热休克组的GSH水平下降。即使在来自早期窦卵泡的OCGC的牛IVG中,卵母细胞的直径也会显着变大。此外,在OCGC的IVG培养过程中,颗粒细胞的数量在第4天和第12天之间显着增加。因此,随着培养时间的延长,对GSH合成的氨基酸(半胱氨酸、谷氨酸、甘氨酸)的需求可能会增加,以支持卵母细胞的生长、颗粒细胞的增殖,并维持OCGCs的氧化应激。因此,在此期间从卵丘颗粒细胞到卵母细胞的GSH供应可能在热休克组中有所减少。虽然我们假设热休克组中的GSH消耗也可能是由于生长中的卵母细胞与周围卵丘细胞之间的细胞内通讯受损引起的,但对照组和热休克组之间的TZP数量没有差异。结果表明,热休克组中卵母细胞与周围细胞之间的通讯可以维持在与对照组相同的水平,而热休克组中颗粒细胞或卵母细胞本身的谷胱甘肽产生减少。在未来的研究中,我们应该检查OCGCs中与GSH合成和消耗相关的酶及其氨基酸代谢,这是IVG培养基中GSH合成所必需的。
与对照组相比,热休克组的OCGC表现出较低的发育能力,同时卵母细胞中的细胞内GSH水平降低。此外,刺激GSH合成的半胱氨酸的补充增加了体外受精期间暴露于高温的卵母细胞的细胞内GSH水平和发育能力。表明IVM之前或之后卵母细胞中的低GSH水平与其发育能力受损之间存在关系。IVM期间的热暴露或在IVM前培养基中添加GSH合成抑制剂会降低卵母细胞中的细胞内GSH水平及其发育能力。这种受到细胞内GSH耗竭导致的卵母细胞发育能力降低可能是由于随后胚胎发育过程中抗氧化能力的降低。目前的结果表明,在生长期的OCGC热暴露会通过耗尽卵母细胞细胞质中的GSH来损害发育能力。
本研究表明,来源于早期窦卵泡的OCGCs在生理范围内对高温敏感。早期窦卵泡(直径0.5-1mm)发育成大的优势卵泡大约需要一个月的时间;因此,夏季早期窦卵泡受热导致的卵母细胞发育能力受损可能与随后较冷的秋季生育能力低下有关。一些提高夏季抗氧化能力的治疗或喂养管理可以改善热应激对早期窦卵泡的负面影响,从而提高秋季的卵母细胞质量和生育能力。本研究中开发的培养系统可以替代体内试验,以寻找可能的抗氧化剂来改善夏季热应激持续影响导致的低卵母细胞质量和生育能力。
总之,早期窦卵泡OCGC在IVG培养过程中的热暴露会损害卵母细胞的生长和发育至囊胚期的卵母细胞百分比。本研究表明,卵母细胞内GSH耗竭(抗氧化能力下降)是夏季热应激导致卵母细胞发育能力低下的原因之一,这可能导致随后秋季的生育能力受损。然而,我们在本研究中关注生理范围内的高温对生长期培养的卵母细胞的影响。体内季节性热应激引起的GV卵母细胞发育能力低下不仅涉及体温高,而且促性腺激素分泌和代谢系统的改变也将参与其中。需要进一步的研究来阐明夏季热应激在卵母细胞生长过程中降低卵母细胞能力的更详细机制。
来源:Kohei Kawano, Kenichiro Sakaguchi,et al. Effect of heat exposure on the growth and developmental competence of bovine oocytes derived from early antral follicles[J]. Scientific Reports ,2022, 12:8857
编译:佳斌